Estructura química y tridimensional de las proteínas
|
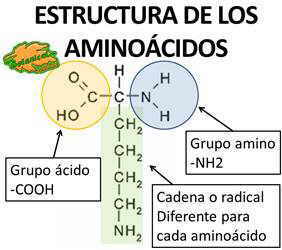
Estructura química de las proteínas
Las PROTEÍNAS están formadas por la unión de cientos o miles de aminoácidos.
Químicamente contienen los mismos átomos que los hidratos de carbono o las grasas: carbono, hidrógeno y oxígeno, pero, a diferencia de estas, las proteínas contienen nitrógeno y algunas veces azufre (aminoácidos azufrados como la metionina).
Los aminoácidos se unen entre sí formando péptidos (unión de varios aminoácidos), polipéptidos (cientos de aminoácidos) o largas cadenas, formando grandes proteínas (miles de aminoácidos).
Las proteínas de menor tamaño contienen entre 25 y 100 aminoácidos, por ejemplo, la proteína ferredoxina o la hormona insulina. La mayoría de proteínas contienen entre 100 y 500 aminoácidos, y las más largas pueden tener hasta 3000 monómeros.
Las proteínas tienen la característica de plegarse de forma distinta en función de los aminoácidos que contiene. Esto es debido a la atracción que surge entre los átomos que contienen sus aminoácidos, que originan diferentes enlaces entre moléculas.
Existen 20 aminoácidos distintos en la naturaleza, y sus combinaciones son casi ilimitadas, resultando muchas proteínas distintas. La estructura de las proteínas se estudia principalmente en tres estadios:
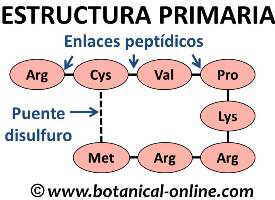
Estructura primaria de las proteínas
Los aminoácidos se unen entre sí mediante enlaces peptídicos. El enlace peptídico es un tipo de enlace covalente entre un átomo de carbono y nitrógeno, producido por la unión de grupo carboxilo de un aminoácido con el grupo amino del otro aminoácido al que se une, perdiendo agua. Este enlace, de tipo covalente, es muy estable y resistente, lo que hace posible que se puedan formar grandes moléculas.
En esta primera estructura también se pueden formar puentes disulfuro si en la cadena existen aminoácidos sulfurados (metionina, cistina, cisteína).
Estructura secundaria de las proteínas
La estructura secundaria de las proteínas consiste en el pliegue de la molécula en función de los aminoácidos que contiene y sus enlaces. Los átomos de los aminoácidos enlazados se atraen formando puentes de hidrógeno, que originan una disposición u organización en el espacio en forma de hélice alfa o hebra beta.
- Hélice alfa: Organización de la cadena de aminoácidos en el espacio en forma de hélice (giro helicoide dextrógiro). En este enlace participan los enlaces peptídicos (los grupos amino y carboxilo de cada aminoácido), se forman enlaces o puentes de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue. Los enlaces peptídicos se sitúan en el centro de la hélice, mientras que los radicales o cadenas de aminoácidos se sitúan en el exterior.
- Hebra beta: Los aminoácidos forman una cadena en forma de zigzag, llamada también disposición en lámina plegada. Se constituye, igual que en el caso anterior, de puentes de hidrógeno, pero en este caso, se producen enlaces intercatenarios, entre cadenas de aminoácidos adyacentes.
- Hélice de colágeno: Es una estructura peculiar debido a la riqueza en dos aminoácidos de esta proteína: la prolina y la hidroxiprolina, que se comportan de forma distinta (por su estructura no pueden girar en el espacio y formar hélices alfa).
- Estructura al azar: Las proteínas no adquieren ninguna estructura.
Desnaturalización de la proteína
Los puentes de hidrógeno son enlaces débiles, que pueden verse afectados por cambios de temperatura o de pH, cambiando la estructura de la proteína y sus propiedades.
Por ejemplo, la proteína del pescado reacciona ante un pH ácido como el jugo de limón, y esto se producen cambios al macerarlo.
Por este motivo también cuaja la proteína de la leche cuando se le añade un ácido (o por la fermentación ácida de las bacterias acidolácticas), debido a que el ácido láctico cambia el pH.
Estructura terciaria de las proteínas
Es la estructura tridimensional completa de una proteína, formada por varios tramos de estructuras secundarias diferentes. Se produce por el pliegue de las hélices o láminas plegadas sobre sí mismas, originando proteínas globulares (esferoproteínas) o fibrosas (filamentosas o escleroproteínas). Se puede dar el caso que una proteína se constituya de formas hélice alfa y láminas plegadas (heteroproteínas).
La estructura terciaria de una proteína es la que otorga las propiedades físico-químicas de la molécula, como su polaridad, solubilidad, etc.
- Solubilidad: Si abundan los radicales hidrófilos, la proteína será soluble. Si abundan los radicales hidrófobos, la proteína será insoluble.
- Especificidad: La función de cada proteína viene dada por su estructura terciaria.
- Desnaturalización: Cambios en la estructura secundaria (puentes de hidrógeno) que cambian la estructura terciaria de la molécula. Estos cambios se producen por cambios de pH (medio ácido o alcalino) o de temperatura (cocción, congelación,…)
Estructura cuaternaria de las proteínas
Unión de distintas proteínas entre sí por puentes de hidrógeno o asociaciones hidrofóbicas. Cada proteína de la cadena conserva su estructura terciaria, y los enlaces que las unen son débiles. Esta asociación se denomina protómero.
Un ejemplo de esta asociación es el colágeno, una proteína fibrosa formada por la unión de varias proteínas (tropocolágeno).
Otro ejemplo es la molécula de hemoglobina, constituida por cuatro cadenas polipeptídicas o subunidades, unidas entre sí. Su estructura cambia en función de si lleva oxígeno o si lleva hidróxido de carbono, siendo posible así la respiración celular.
Tipos de proteínas
- Esferoproteínas: Protaminas, histonas, prolaminas, gluteninas, albúminas, globulinas
- Escleroproteínas: Colágeno, elastinas, queratinas, fibroínas
- Heteroproteínas: Cromoproteínas, glucoproteínas, lipoproteínas, fosfoproteínas, nucleoproteínas
![]() Más información sobre las propiedades de las proteínas y tipos.
Más información sobre las propiedades de las proteínas y tipos.
11 junio, 2025